- HOME
- 刊行物のご案内
- 心理学ワールド
- 95号 ヒトのアタッチメント再考
- 養育に関与する経験とホルモンの相互作用
【特集】
養育に関与する経験とホルモンの相互作用

菊水 健史(きくすい たけふみ)
Profile─菊水 健史
東京大学獣医学科卒。獣医学博士。2017年より現職。専門は行動神経科学,行動内分泌学,行動遺伝学。動物における社会コミュニケーションとその中枢機能,遺伝基盤に関する研究に従事。単著に『愛と分子』(東京化学同人),『社会の起源:動物における群れの意味』(共立出版),共著に『日本の犬:人とともに生きる』(東京大学出版会),『犬のココロをよむ』(岩波科学ライブラリー)など。
妊娠出産によるホルモン変化と養育行動
性経験や育仔経験のないげっ歯類のメスは出産前,仔マウスや仔ラットを忌避する。その後出産を経るとただちに養育行動を示し,母性行動を獲得する。このような劇的な行動の変化をもたらす要因として妊娠や出産に伴って変化する内分泌の機能,特に生殖腺から分泌されるエストロゲンやプロゲステロンの動態と,中枢におけるその受容体分布の変化が知られている。脳内部位として,視床下部内側視索前野(mPOA)が重要である。この部位には母性ホルモンと呼ばれるオキシトシンの受容体の発現も多く,オキシトシンの受容体が分娩前のエストロゲン上昇によって増加する。例えばオキシトシン神経細胞が多く存在する視床下部室傍核(PVN)の破壊やオキシトシンの作用阻害薬を分娩後のメスラットに投与すると養育行動の発現が阻害されることから,養育行動の誘起には,オキシトシンの分泌が必要であり,PVNで産生されたオキシトシンがmPOAに運ばれて,作用することで母性行動が誘起されると考えられている1。興味深いことに,一度養育行動を獲得したメスラットのオキシトシン機能を阻害しても母性行動は維持されることから,オキシトシンの役割は母性の獲得であろうと考えられている。
妊娠や出産に伴う内分泌の変化だけが母性行動の発現を促しているわけではない。げっ歯類では,メス個体が仔との触れ合いによって得られる接触シグナルが養育行動の発現と維持に重要である。たとえ分娩を経験していても,その後に仔を隔離し,母個体と直接接触できないようにしておくと,仔に対する反応性が1週間程度で減少する2。このことは,分娩後の養育行動の維持には,母と仔が身体的に接触する必要があることを意味する。とくに仔から母の乳房への吸乳シグナルは乳汁射出を刺激するためにオキシトシンの分泌を増加させるが,このとき分泌されたオキシトシンは,末梢血中を介して乳腺に作用するだけでなく,中枢神経系に作用して養育行動の発現を促す1。また毛づくろいなどの接触シグナルでもオキシトシンの分泌が生じることから,オキシトシンが母仔の接触と高レベルの養育行動の維持を仲介していると考えられる。このことからオキシトシンは母子間の関係性,特に子からのアタッチメントと養育の経験依存的な行為を介した絆の形成の中心的役割を担うといえよう3。
子からのアタッチメントシグナルと母親の選択的養育行動の発現
アタッチメント行動とは,特定の対象との近接によってネガティブな情動を軽減するための行動システムである。典型的には,母子間のような幼弱−擁護者の関係性において,子が親を引き寄せ,自身のストレスや不安を軽減させるための行動と言える。多くの哺乳類の仔は体温調節や運動機能が未熟な状態で生まれてくるため,生後間もないころから親の養育行動を惹起するために様々なアタッチメントシグナルを発する。その中で,仔がもつ特有の嗅覚シグナルは親が仔を認知するために重要なシグナルで,その例としてヒツジがあげられる。ヒツジは比較的大きな群れで生活する季節繁殖動物である。このような動物では,群れで同じ時期に出産があるため,自分自身の仔を他のヒツジの仔と見分けて,育てなくてはならない。このような養育行動の選択性は出産後,仔に付着している羊膜の匂いを人工的に洗い流すことで消失する。また,羊膜の匂いを自身の仔ではないほかの仔に付着させると,その仔に対して養育行動を示すようになることが報告されていることから,自分の子への選択的養育行動は,子からの嗅覚シグナルを母が記憶することに依存していることがわかる4。
げっ歯類でも仔の認知において嗅覚シグナルは重要である。特に初産のマウスは仔から発せられる嗅覚シグナルによって養育行動が誘起される。たとえば,初産のメスマウスの嗅球を除去すると適切な養育行動が発現せず,仔殺しが観察される。その一方で,すでに育仔をしたことがある母マウスでは嗅球除去をしても養育行動の発現は阻害されない。また,たとえ初産のメスマウスであっても,出産前に実験的に何度も他の仔に暴露しておくことで,嗅球除去による養育行動障害はみられなくなる5。
仔が発する聴覚シグナル,すなわち仔の鳴き声も嗅覚シグナル同様に養育行動を誘起する。聴覚シグナルは,離れてしまい姿が見えなくなってしまった親をすぐさま呼ぶのに適したアタッチメントシグナルであり,ヒツジやブタなどの親は,仔の鳴き声を頼りに離れた仔のもとに近寄っていく。げっ歯類の仔も巣や親から隔離されると幅広い超音波領域の音声を発する。母マウスは分離された仔マウスが出す超音波に接近行動を示し,仔マウスを探索するような行動を見せる。この接近行動は,人工的に超音波の周波数や持続時間を変更すると消失することから,母マウスは仔マウスの発する超音波音声の特徴を知り,それを手がかりに仔マウスを探して巣戻し行動を示すと考えられる6。また出産経験や育児経験のないメスマウスでは仔マウスの出す鳴き声への接近行動が観察されないが,交尾経験や育仔経験を経ると仔マウス超音波への反応性が獲得される7。近年の神経細胞を対象とした電気生理学的研究によって,育仔経験のないメスマウスの聴覚野では,仔マウス超音波に対して神経細胞は高い活性を示さないものの,母マウスになると特異的な活性を示すことが報告された8。この可塑的変化には視床下部からのオキシトシンの分泌が必要で,オキシトシンを介して,仔マウスの声に反応する神経回路が構築される。このように,仔マウスの鳴く声に対しての反応性は,養育経験を経て,聴覚野の感覚受容細胞の可塑的変化を伴うことが明らかにされつつある。
アタッチメントシグナルとオキシトシン
分娩や吸乳の刺激により母親の脳内で放出されたオキシトシンの一部は,嗅球に到達して神経細胞を興奮させる。このときに仔の嗅覚シグナルが嗅球に入力されることで,仔の匂いに選択的に反応する神経回路が形成され,この“記憶”を頼りに自身の仔に特異的な養育行動を呈するようになる9。この出産24時間以内という感受期は極めて厳密に制御されているようで,この間に仔の匂い刺激への曝露を妨げる,あるいは嗅球にオキシトシン阻害薬を投与して記憶形成を阻害すると,母ヒツジは仔を拒絶するようになる9。
ラットやマウスでも仔におけるアタッチメント行動の発現にもオキシトシンが関与する。たとえば,ラットの幼若個体にオキシトシンを投与すると,母個体から分離されたときに発する超音波の発生回数が減少する10。このことから,母個体との接触によるオキシトシンの分泌上昇が仔に安寧効果をもたらし,結果として鳴き声が低下すると思われる。このようにオキシトシンは母個体の養育行動と仔のアタッチメント行動の両方を制御することで,状況に応じた母仔の適切な行動発現を調整し,より強固な生物学的絆を形成する体内因子として機能していると考えられる。
オキシトシンの中枢機能
近年の分子遺伝学研究は,これまでの技術ではなしえなかった神経メカニズムの解明に寄与してきた。オキシトシン分子あるいは受容体の遺伝子の欠損マウスでは,個体識別能に障害が認められ,出会った相手を覚えられない11。このことから,オキシトシンの根本的な生理的役割の一つは社会的認知と記憶形成といえる。その他,オキシトシン神経系を遺伝的に操作したマウスの研究から,オキシトシンが個体認知や社会的意思決定,不安記憶の形成などに深くかかわることが示されてきた11。
上述の母性行動の経験依存的獲得にもオキシトシンが関与する。処女メスマウスと母マウスを同居させておくと,次第に処女マウスも母性行動を示すようになる。筆者らの最近の研究で,母マウスが処女マウスに積極的に育児を教えること,その経験時に処女マウスのオキシトシン分泌が起こり,それを介して育児行動が獲得されることが分かった。行動を詳細に解析すると,処女マウスは母マウスから巣に連れてこられたり,目の前に仔マウスを置かれたりと,積極的な養育参加が促される。その際,処女マウスのオキシトシンが分泌され,そのオキシトシンが養育にかかわる中枢を形成していた。
このように,オキシトシンは社会認知と母性行動の発現の双方にとって極めて重要である。オキシトシンの作用によって,母子や雌雄間のパートナーが認識し合い,お互いを結びつけているというのは妥当な解釈といえる。オキシトシンは,ヒトを含む多様な脊椎動物種に広く保存されている古典的な神経ペプチドである。それゆえ,個体レベルの行動の理解のみならず,進化や動物行動学の観点から絆の形成の生物学的意義を理解するうえで,オキシトシンは極めて興味深く,重要な分子といえるだろう。
オキシトシンを介した3つのポジティブループ
ラットやマウスは多産で,一回の出産で8匹前後の仔を産む。時に2匹あるいは3匹程度しか生まれない場合があるが,この時には仔からの出産直後のアタッチメントシグナルとしての吸乳刺激が弱いため,母性行動が誘起できず母親は仔を見捨てて,食殺につながる。つまり,母性は仔からの強いアタッチメント行動が育てていることになる。一方,母親からの養育行動は仔の身体的な成長と共に社会性を育んでいく。仔が親を育て,親が仔を育てる,という双方向性の関係性が成立し,その過程を経ながら絆が形成される。この絆の形成は生得的なものだけではなく,母と仔の双方から発せられる視覚・触覚・嗅覚・聴覚などの感覚系を介したシグナルのやり取りの経験が重要である3。母子間の絆形成において,げっ歯類などの動物実験から皮膚接触の刺激は極めて重要であることが示されている。絆が形成されれば,母親が安全基地として機能し,社会的緩衝作用によって幼若個体を過剰なストレスから守ることができるようになる。母仔間の関係性は一時的な効果だけではない。安定した養育環境を過ごすことで,仔は正常な情動や社会行動を発達させることができる。例えば幼少期の母仔間の絆形成が略奪されたアカゲザルでは,成長後の親和行動の障害が認められ,さらに他個体のストレス反応を減弱させる社会的緩衝作用に関わる機能も低下する12。このことから母仔間の関係性は,情動や社会性の発達にも関わる大きな要因といえよう。
上述のように,分娩や育仔などの社会経験はオキシトシン神経系を活性化させ養育行動を促す。このときに経験する育仔行動は母個体のオキシトシン神経系を活性化させ,養育行動の発現をさらに高める。このことから,母個体のオキシトシン神経系の活性と養育行動はポジティブループを形成しているといえる3。また,養育行動を受けることで仔のオキシトシン神経系も刺激され,探索行動などのアタッチメント行動の発現が強化される。アタッチメント行動は乳房吸乳などの接触刺激を介して母個体のオキシトシン神経系を活性化し,養育行動をさらに賦活化する。つまり,母から仔への養育行動と仔から母へのアタッチメント行動も正のフィードバックとして機能し,母仔間の生物学的絆の形成をより強固なものとする。これらオキシトシン神経を介した,アタッチメント行動と養育行動という2つの正のフィードバックが母と仔の間に存在し,2個体間でポジティブループが機能することがわかる3。
さらに,母仔関係のポジティブループはこれら2つにとどまらない。発達時に母親から密な養育行動を受けると,そのメスの仔が成長後に母親になると,同じようにわが子に対して高い養育行動を示すようになる。これは世代をも超えたポジティブループが存在していると言える。コロンビア大学のChampagneは,母子間の絆が略奪された場合の,子の神経系ならびに行動変化を調べた。母親からの養育行動の一つである毛づくろい行動を受けた頻度によって,将来の母性行動の発現が大きく変わること,そのときオキシトシン受容体の発現が変化することを明らかにしている13。
これらを踏まえると個体,母仔間,そして世代間における3つのポジティブループが存在し,それぞれが別個に機能するのではなく,互いに密接に結びつくことで巨大な円環を構築していることが概観できる(図1)。まさに親和的関係性が社会の中で継代されている,そこにオキシトシン神経系が関与することが分かってきたといえるだろう3。
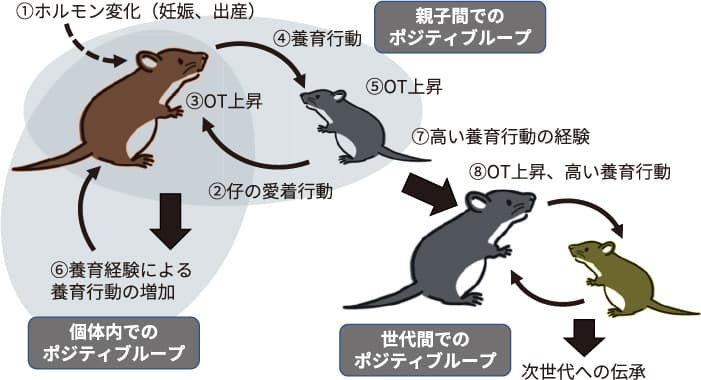
妊娠出産に際し,メスの体内では劇的な内分泌変化が生じ,これが養育行動の発現の基盤を形成する(①)。分娩後,仔からの愛着行動,特に吸乳刺激(②)が母親の脳内のオキシトシン分泌を高める(③)。オキシトシンの分泌により,養育行動が発動する(④)。養育行動を受けた仔マウスでも脳内でオキシトシンが分布され(⑤),オキシトシンを介した「母子間でのポジティブループ」が駆動する。また養育経験自体も,オキシトシンを介して養育行動をさらに高める,「個体内でのポジティブループ」がある(⑥)。さらに幼少期に多くの養育経験を得たメスマウスでは(⑦),自身が母親になった際には高いオキシトシン神経系の活性化とそれを介した母性行動が知られており,これが「世代間でのポジティブループ」(⑧)となる。
文献
- 1.Okabe, S. et al. (2017). Psychoneuroendocrinology, 79, 20–30.
- 2.Fleming, A. S. et al. (1999). Neurosci. Biobehav. Rev., 23, 673–685.
- 3.Nagasawa, M. et al. (2012). Front. Hum. Neurosci., 6, 31.
- 4.Keverne, E. B. et al. (1992). Ann. N. Y. Acad. Sci., 652, 83–101.
- 5.Seegal, R. F. et al. (1974). Physiol. Behav., 13, 339–341.
- 6.Uematsu, A. et al. (2007). Brain Res., 1163, 91–99.
- 7.Okabe, S. et al. (2010). Zoolog. Sci., 27, 790–795.
- 8.Marlin, B. J. et al. (2015). Nature, 520, 499.
- 9.Kendrick, K. M. et al. (2004). J. Neuroendocrinol., 16, 1007–1008.
- 10.Insel, T. R. et al. (1991). Eur. J. Pharmacol., 203, 149–152.
- 11.Ferguson, J. N. et al. (2000). Nat. Genet., 25, 284–288.
- 12.Winslow, J. T. et al. (2003). Neuropsychopharmacology, 28, 910–918.
- 13.Champagne, F. et al. (2001). Proc. Natl. Acad. Sci. U. S. A., 98, 12736–12741.
PDFをダウンロード
1




