- HOME
- 刊行物のご案内
- 心理学ワールド
- 97号 社会が変わる,社会を変える
- 幼少期逆境経験の神経生物学
【小特集】
幼少期逆境経験の神経生物学
袴田 優子(はかまた ゆうこ)
Profile─袴田 優子
2021年より現職。博士(教育学)。専門は,臨床心理学・認知神経科学。
複雑性PTSDとは
この数十年で,地下鉄サリン事件や東日本大震災等を機に,日本でも心的外傷後ストレス障害(posttraumatic stress disorder: PTSD)の名が広く知られるようになり,2018年に公開された国際的な疾患分類システムであるICD–11においては「複雑性PTSD」(complex PTSD: CPTSD)という診断が新たに導入されることになりました。CPTSDは,PTSDの診断基準であるトラウマの再体験,回避,脅威の持続的感覚(過覚醒)に加えて,感情制御困難,否定的自己概念,対人関係障害から構成され,単回性のトラウマというよりはむしろ,長期にわたり持続/反復するトラウマとの関連が強い疾患単位です。持続性トラウマの代表的な例として幼少期における逆境経験(adverse childhood experiences: ACEs)が挙げられます。CPTSDは公式的な診断として成立してから年数が浅いことから,十分な研究知見が得られていないのが現状です。
そこで本稿では,CPTSDと密接に関連するACEsに焦点を当て,その神経生物学的な変異および回復への手がかりについて紐解いてみたいと思います。
ACEsとこころの健康
ACEsとは,幼少期に経験された逆境的な出来事・状況をいい,これには養育者からの虐待やネグレクトが含まれます。先進国の一般人口中3分の1以上の人々がACEsに苦しんだ経験を持つと報告されるほど[1],深刻な社会的問題の一つとなっています。またACEsの加害者の約80%がその子どもの親か他の家族成員であることも指摘されています[1]。かつて著名なイギリスの精神分析家であるジョン・ボウルビィは子どもの安定した精神発達において主たる養育者との愛着形成の重要性を強調しました[2]。古い諺「三つ子の魂百まで」にみられるように,私たち自身もこの洞察が正しいことを経験的に認識しています。そして近年の大規模疫学研究は,ACEsが将来のPTSDやうつ病といったストレスに関連した精神障害の発症リスクを著しく増加させることを実証しており[3],ACEsが人のこころの発達に重大な影響を与えることを科学的に明らかにしています。
ACEsと神経生物学的な“傷”
これまでに集積している複数のメタ分析によれば,ACEsを持つ人々は,視床下部−下垂体−副腎(HPA)系や免疫・炎症系,脳の機能や構造,遺伝子発現等,幅広い領域にわたる変異を示すことが確認されています。これらの変異に関する詳細な報告は私たちの別の論文に譲りますが[4-7],ACEsを持つ人々では概して,心理社会的なストレッサーに対するストレスホルモン・コルチゾールの反応性が鈍化しており,C反応性タンパク(CRP)をはじめとする炎症系物質が増加していることが明らかになっています。また,情動的にネガティブな刺激に対して扁桃体が過剰に反応していることや,海馬の灰白質体積が減少していることも実証されています。さらに,前頭葉と視床の前/内側核群間の神経連絡線維(白質)の統合性が減少していることや,ACEsがグルココルチコイド受容体を含む複数の遺伝子の発現パターンを変化させ,ストレスへの感受性を高めることを示すエビデンスも得られています[4]。
重要なことは,これらの神経生物学的変異は,精神障害を発症したACEs経験者だけではなく,発症していないACEs経験者においても見出されているということです。また,見出された変異の多くは,PTSDやうつ病の患者で見つかっている神経生物学的変異と重複しています[8]。したがって,これらの先行知見は,ACEsによって神経生物学的な“傷”が生じ,この傷が多様なメカニズムを通じて将来の精神障害の発症に寄与する可能性を示唆しています。
しかしながら,ACEsに伴う神経生物学的な傷が一体どのように生じるのかについては未だ明らかになっていません。予てから動物研究は,幼少期に反復的なストレッサーを経験した個体におけるグルココルチコイド(ヒトにおけるコルチゾール)の分泌増加,グルタミン酸レベルの上昇,そしてこれらに伴うNMDA受容体の過剰な活性化の存在を指摘しています[9]。とくに海馬におけるNMDA受容体の過剰刺激は,当該領域における神経細胞死や神経新生阻害,および樹状突起分岐の減少を惹起することが知られています[9]。これは,ヒトのACEsで報告される海馬灰白質体積の減少に関する知見に調和しますが,コルチゾール分泌の鈍化に関する知見とは一見矛盾しています。
おそらく人生早期の段階ではACEsを持つヒトにおいてもコルチゾール分泌過多であった時期が存在したと考えられ,これにより海馬の神経細胞の成長と新生が阻害されるとともに,HPA系の機能不全が生じたのかもしれません。実際に数少ない縦断研究からは,ACEsを持つ児童青年ではコルチゾール分泌が時間の経過とともに減少していくことが報告されています[10],[11]。コルチゾールは一般に免疫・炎症系反応を抑制することから,コルチゾール分泌の鈍化は,慢性の低レベル炎症を招き得ます。これを支持するように別の縦断研究では,ACEsを持つ児童青年のCRPレベルは時間の経過とともに上昇していくことも報告されています[12]。末梢の炎症性物質は通常血液脳関門を通過しませんが炎症が続いた場合には脳への浸潤を生じる[13]など,幾つかの経路を通じて中枢神経系に影響を及ぼします[14](図1)。
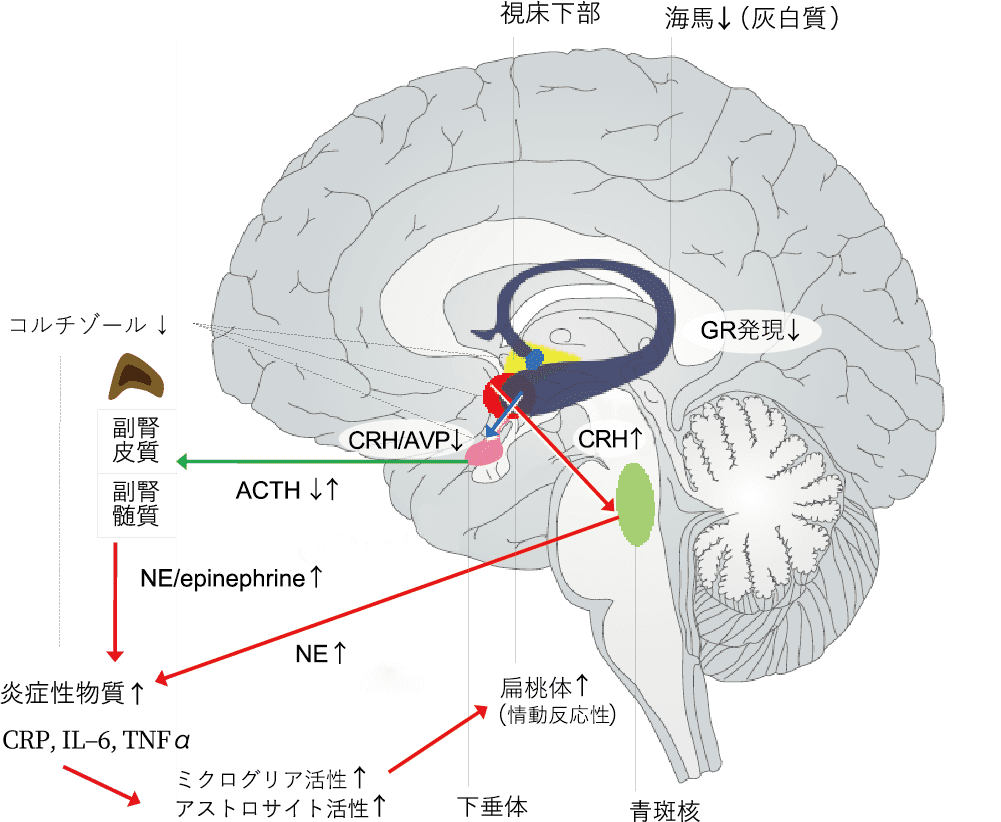
(文献[4]に基づき一部改編して掲載)
ACEsを持つPTSDやうつ病に対する効果的な予防・治療を考えるうえでは,分野横断的かつ縦断的アプローチを用いてACEsがもたらす神経生物学的影響を正しく理解してゆくことが必要です。
ACEsによる“傷”からの回復
上述のようにACEsは,人間の脳および体にさまざまな神経生物学的な“傷”を残す場合があります[15]。しかし最後に,環境の調整や心理社会的な支援によって人はこれらの“傷”から回復し得ることにもまた触れておきたいと思います。
動物研究では,ACEsに伴う海馬の神経新生阻害は,環境エンリッチメント(例:豊富な遊具や知的刺激,他の個体との社会的関わりの充実など)によって抑制されることが報告されています[16]。また人を対象とした研究でも,家族で心理社会的介入を受けたACEsを持つ子どもは,介入を受けなかった対照群と比較して,CRPレベルの経時的上昇が抑制されたこと[17]や,親子で心理療法プログラムに参加したACEsを持つ子どもは,プログラムに参加しなかった対照群と比べて,コルチゾール分泌の経時的鈍化が抑制されていたことも見出されています[10]。
臨床家は,ACEsを持つ人が,少しでもその傷から回復するにはどうしたらよいか,その人が今後その人らしく生きるにはどのような介入・治療が最善かと問い続けてきました。こころという複雑な目に見えない事象を単純に説明することはできませんが,少なくとも科学を通してより良い予防・介入法を模索し,また改善・発展させ続ける姿勢が,私たちには求められています。
文献
- 1.Gilbert, R. et al. (2009) Lancet, 373, 68–81.
- 2.Bowlby, J. (1951) Bull World Health Organ, 3, 355–533.
- 3.Hughes, K. et al. (2017) Lancet Public Health, 2, e356–e366.
- 4.Hakamata, Y. et al. (Accepted) Neurobiology of early life adversity: A systematic review of meta–analyses towards an integrative account of its neurobiological trajectories to mental disorders. Front Neuroendocrinol.
- 5.Hori, H. et al. (2021) Transl Psychiatry, 11, 122.
- 6.Hakamata, Y. et al. (2021) Psychoneuroendocrinology, 127, 105172.
- 7.Hori, H., Hakamata, Y. et al. (In press) Brain Behav Immun.
- 8.Ploski, J. E. (2021) Biol Psychiatry, 90, 109–117.
- 9.Sandi, C. (2004) Nat Rev Neurosci, 5, 917–930.
- 10.Hagan, M. et al. (2021) Psychoneuroendocrinology, 133, 105389.
- 11.Simsek, S. et al. (2015) Psychoneuroendocrinology, 56, 45–51.
- 12.Slopen, N. et al. (2013) Psychoneuroendocrinology, 38, 188–200.
- 13.Galea I. (2021) Cell Mol Immunol, 18, 2489–2501.
- 14.Dantzer, R. et al. (2008) Nat Rev Neurosci, 9, 46–56.
- 15.Bremner, J. D. (1999) Biol Psychiatry, 45, 797–805.
- 16.Rule, L. et al. (2021) Mol Psychiatry, 26, 1898–1908.
- 17.Miller, G. E. et al. (2014) Proc Natl Acad Sci USA, 111, 11287–11292.
- *COI:本稿に関連して申告すべき利益相反はありません。
PDFをダウンロード
1




